За последние десять лет производительность биотехнологических процессов значительно возросла как в лабораторных, так и в промышленных реакторах. Тем не менее этот рост сопровождается дополнительными сложностями — ускоренным накоплением в биореакторе нежелательных побочных продуктов, например, производных молочной кислоты и растворенного CO2 (dCO2).
Отрицательное влияние избыточной и недостаточной концентрации dCO2
Высокая концентрация dCO2 в биореакторах вызывает сдвиг метаболизма и подавляет рост клеток. При очень высоких концентрациях (200–250 мм рт. ст.) dCO2 токсичен для клеток млекопитающих, что может в отсутствие эффективного регулирования привести к потере продукта. Многочисленные исследования показывают, что отрицательное влияние dCO2 связано со снижением рН внутриклеточной (pHi) и межклеточной среды (pH1–4) по следующим схемам:
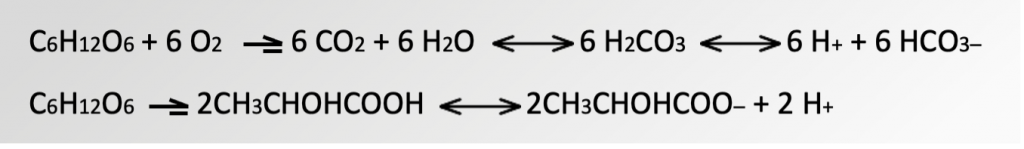
Уравнения 1 и 2. dCO2 снижает уровень внутриклеточного и межклеточного рН
В каждом отдельном случае ширина оптимального диапазона концентрации dCO2 зависит от специфики процесса и выбора рекомбинантной клеточной линии.
Снижение концентрации dCO2 (ниже 5 %) также отрицательно влияет на выход продукта, так как приводит к возникновению механической нагрузки на клетки. Низкую концентрацию dCO2 можно корректировать с помощью барботажа или дополнительной подачи.
Способы регулирования концентрации растворенного dCO2
Высокую концентрацию dCO2 можно корректировать добавлением щелочного раствора до возвращения показателя рН в нужный диапазон. Считается, что клеточная культура стабильна, если объем добавок щелочного раствора минимален, что косвенно указывает на низкую концентрацию dCO2 в питательной среде. В свою очередь, сокращение количества щелочи может привести к снижению парциального давления CO2 (pCO2) в конце производственного цикла, когда концентрация лактата, как правило, уменьшается. На эффективность дегазации могут также влиять состав питательной среды и применение добавок (например, пеногасителей).
Для разных биореакторов требуется разный подход к удалению CO2, поскольку он зависит от объема и типоразмера (H/D) биореактора, а также от конструкции аэратора. Методика удаления CO2 уникальна для каждого технологического режима, реактора и клеточной линии.
Недостатки анализаторов газов крови и других автономных методов
Измерения с помощью анализаторов газов крови (BGA) и других автономных или расположенных «у линии» приборов не подходят для оперативного технологического контроля из-за большого интервала (1–2 пробы в день). Отбор проб из технологической среды связан с риском внешних воздействий, искажающих характеристики пробы.
Преимущества непосредственного измерения в режиме реального времени
Использование встроенных датчиков dCO2 в биореакторах позволяет получать точные результаты в режиме реального времени, которые можно использовать для регулирования концентрации CO2 независимо от типоразмера биореактора (соотношения H/D), типа отдувочного газа или клеточной линии. Регулирование dCO2 может повысить скорость роста клеток на 30%, а удельную производительность реактора по клеткам млекопитающих и насекомых — более чем на 30 %.
Решение МЕТТЛЕР ТОЛЕДО
Встроенный датчик InPro 5000 i МЕТТЛЕР ТОЛЕДО по конструкции аналогичен потенциометрическому электроду Северингауза, который применяется в анализаторах газов крови, и измеряет концентрацию dCO2в диапазоне, характерном для среды выращивания микроорганизмов. Ошибки, связанные с процедурой отбора проб, исключаются. Также исключены недостатки, свойственные датчикам с ИК-детектированием – невысокая селективность из-за значительной ширины полос поглощения CO2, мешающее влияние молекул воды.
В датчике InPro 5000 i используется бикарбонатная буферная система, отделенная от технологической среды запатентованной селективно-проницаемой мембраной (рис. 1).
Рис. 1. Основные компоненты датчика InPro 5000i
Растворенный в технологической среде CO2 диффундирует сквозь мембрану до достижения равновесия с буферным раствором. Изменение парциального давления CO2 приводит к изменению уровня pH в электролите, которое регистрирует внутренний pH-электрод. Уровень рН буферной системы непосредственно связан с парциальным давлением растворенного в технологической среде CO2 по следующей схеме:
Уравнение 3. Химическое взаимодействие CO2 с водой
Подставляя константы равновесия из уравнения 3 в уравнение Генри (CCO2 = a·pCO2), получаем зависимость pH от парциального давления PCO2 (уравнение 4).
Уравнение 4. Взаимосвязь между pH и парциальным давлением CO2
Константы KCO2 и KH в уравнении 4 относятся к CO2 и буферному раствору (электролиту CO2), который используется в датчике InPro 5000i.
Конструкция датчика InPro 5000 i соответствует санитарным требованиям. Надежность, точность измерения (± 1–2 % от измеряемой величины) и время отклика датчика не зависят от колебаний рН или концентрации метаболитов, таких как глюкоза, глютамин, глютаматы, лактаты и аммоний.
Скачать полную версию статьи о контроле CO2 для оптимизации процесса культивирования клеток