На заседании секции «Боль и обезболивание», подготовленном комитетом ФАР по лечению боли, с докладом «Применение селективных агонистов опиоидных рецепторов в послеоперационном периоде» выступил Карелов Алексей Евгеньевич – д. м. н., профессор кафедры анестезиологии и реаниматологии им. В. Л. Ваневского, руководитель Центра лечения боли ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И. И. Мечникова» Минздрава России, председатель комитета по лечению боли ФАР, г. Санкт-Петербург.
Несмотря на успехи анестезиологии последних десятилетий, проблема эффективности послеоперационного обезболивания по-прежнему остается актуальной. Так, по данным различных исследований (Dolin S. et al., 2002, Apfelbaum J.L. et al., 2003Chang G. et al., 2014 Buvanendran A. et al., 2015, Chou R. et al., 2016), выраженный болевой синдром после операции встречается у 35-75% пациентов.
Золотым стандартом послеоперационного обезболивания на сегодняшний день является пациент-контролируемая анальгезия сильными полными опиоидными агонистами. Однако в нашей стране данный метод не имеет широкого распространения из-за сохраняющегося дефицита специализированного оборудования, недостаточной подготовки медперсонала, бюрократического аспекта при назначении опиоидных агонистов. В результате практический врач вынужден применять полные агонисты опиоидных рецепторов, используя принципы «по часам» или «по требованию». Наибольшее распространение в нашей стране получили тримеперидин, трамадол и морфин.
Как известно, опиоидные агонисты работают в организме посредством активации группы специфических рецепторов, так называемых опиоидных рецепторов. Эту группу составляют мю-, каппа-, дельта-, сигма-, эпсилон- и дзета- опиоидные рецепторы. Из них три первых типа обеспечивают деятельность опиоидергического компонента естественной антиноцицептивной системы организма. Эндогенными лигандами мю-, каппа-, дельта-рецепторов являются эндорфины, динорфины, энкефалины соответственно. Эти и другие вещества вместе с их рецепторами представляют собой опиоидную медиаторную систему.
Опиоидная система регуляции имеет широкое распространение в нейронных тканях, включая нейроэндокринную и иммунную системы, а также эктодермальные клетки. Ее активность обуславливают изменения эмоциональной сферы и системы поощрения, угнетение дыхания, размножение, рост, миоз, запор, иммуносупрессия и др. Она участвует в управлении, как сказано выше, деятельности антиноцицептивной системы в ЦНС.
Опиоидные рецепторы – это G-протеин-связанные рецепторы, относятся к подгруппе с семью гидрофобными трансмембранными доменами класса А. Связывание лиганда с опиоидным рецептором ведет к срабатыванию двух основных путей внутриклеточных преобразований с разной степенью предпочтения: через G-белок и/или через β-аррестин. И если интрацеллюлярный сигналинг посредством G-белка представляется оптимальным путем внутриклеточной передачи информации, то сигнальный путь β-аррестина обусловливает десенсибилизацию и интернализации рецепторов, что, в свою очередь, ведет к развитию толерантности к опиоидам и другим нежелательным последствиям.
Раскрытие вышеописанного комплекса реакций на взаимодействие лиганда с рецептором позволило сформулировать концепцию функциональной селективности лигандов или концепцию специфичности сигнального пути конкретного агониста. Эта концепция позволяет объяснить различия в спектре и выраженности побочных эффектов полных агонистов опиоидных рецепторов. Кроме того, она раскрывает перспективы в поиске новых опиоидных лигандов, которые могут стать анальгетическими препаратами для клинической работы.
При активации мю-рецепторов характерно развитие обезболивания, тошноты, рвоты, запоров, угнетения дыхания, толерантности, зависимости, миоза. С активацией каппа-рецепторов связывают развитие обезболивания, миоза, седации, реакции психологического отторжения, ангедонии, появления дисфории и галлюцинаций. При стимуляции дельта-рецепторов помимо обезболивания наблюдаются седация, судороги и др.
Одним из возможных направлений борьбы с тяжелыми побочными эффектами при применении опиоидных агонистов считается поиск и внедрение в клиническую работу селективных агонистов подтипов опиоидных рецепторов, активация которых обеспечивает выраженное обезболивание при хорошей переносимости терапии. Поэтому последние годы во всем мире продолжался поиск молекул, которые бы обладали селективным действием в отношении мю-рецепторов с меньшим риском развития опиоид-ассоциированных нежелательных явлений.
Пептидные анальгетики, которые являются лигандами опиоидных рецепторов, действуют на уровне головного и спинного мозга и активируют центральное (супрасегментарное) ингибирование ноцицептивной трансмиссии. Сегодня становится очевидным, что представители этой фармакологической группы имеют большие перспективы стать альтернативой полным агонистам опиоидных рецепторов и могут стать революционным шагом в обезболивании.
В 2022 году в РФ был зарегистрирован первый пептидный анальгетик, который на сегодняшний день не имеет аналогов не только в России, но и в мире. Это препарат «Тафалгин», раствор для [строго] подкожного введения (ЗАО «ФармФирма „Сотекс”», Россия) с действующим веществом тирозил-D-аргинил-фенилаланил-глицин амида. «Тафалгин» является селективным мю1-агонистом (взаимодействие с дельта-рецепторами на три порядка ниже, а с другими рецепторами не определяется). Его ведущий фармакологический эффект – это обезболивание, а показанием для назначения, исходя из инструкции производителя к его применению, является боль умеренная и тяжелая, в том числе у онкологических пациентов. Дозировка «Тафалгина» подбирается индивидуально, до достижения адекватного обезболивания: разовая доза варьирует от 2 до 7 мг, а максимальная суточная доза может быть равной 42 мг. При этом оптимальным режимом дозирования является введение препарата «Тафалгин» по 4 мг два-три раза в сутки, хотя допускается четырехразовое применение за сутки.
В клиническом исследовании третьей фазы, в котором приняло участие 179 пациентов с хроническим болевым синдромом, вызванным онкологическими заболеваниями или последствием их лечения, была показана высокая эффективность «Тафалгина», не уступающая морфину.
Пациенты были рандомизированы в две группы: первая (n=120) получала только «Тафалгин» подкожно, вторая (n=59) – таблетки морфина 28 дней (период 1) и далее «Тафалгин» 28 дней (период 2).

При оценке безопасности терапии в группах «Тафалгина» и морфина было выявлено, что нежелательные явления в группе «Тафалгина» возникали достоверно реже (p=0,00001): у 36,7% пациентов (44/120) в группе «Тафалгина» против 72,9% пациентов (43/59) в группе морфина.
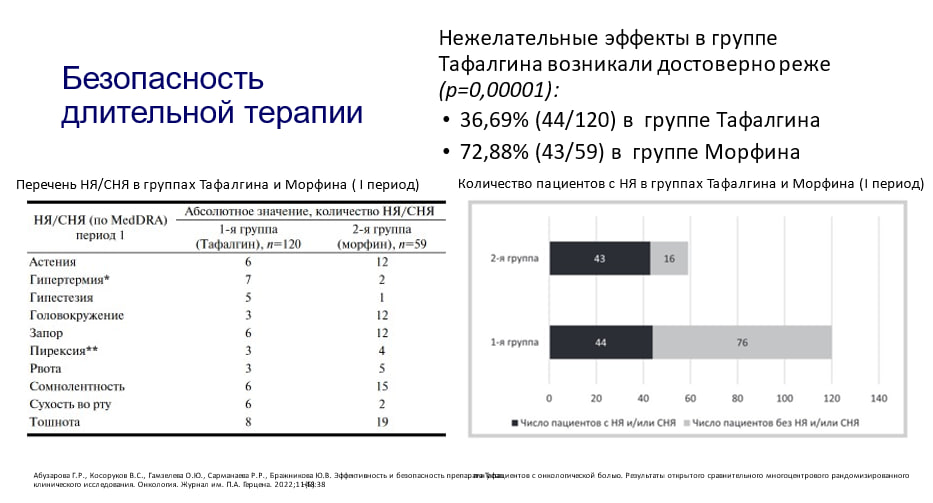
Данные этого исследования соответствуют результатам нашего клинического опыта, полученного в университетской клинике, при выполнении обезболивания у 20 пациентов после различных оперативных вмешательств, таких как лапароскопическая холецистэктомия, устранение вентральной грыжи, резекция желудка и резекция кишечника. Пациенты получали «Тафалгин» в составе мультимодальной анальгезии вместе с парацетамолом и НПВС (кетопрофеном).
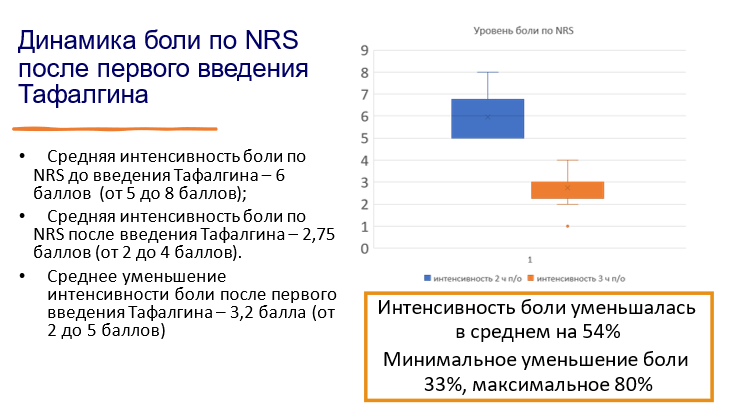
Первое введение «Тафалгина» (4 мг п/к) в среднем через два часа после операции выполняли пациентам, у которых парацетамол в сочетании с НПВС недостаточно купировал боль. После применения «Тафалгина» интенсивность боли с уровня 5-8 баллов по шкале NRS падала на 54% (до 2,8 балла по шкале NRS).
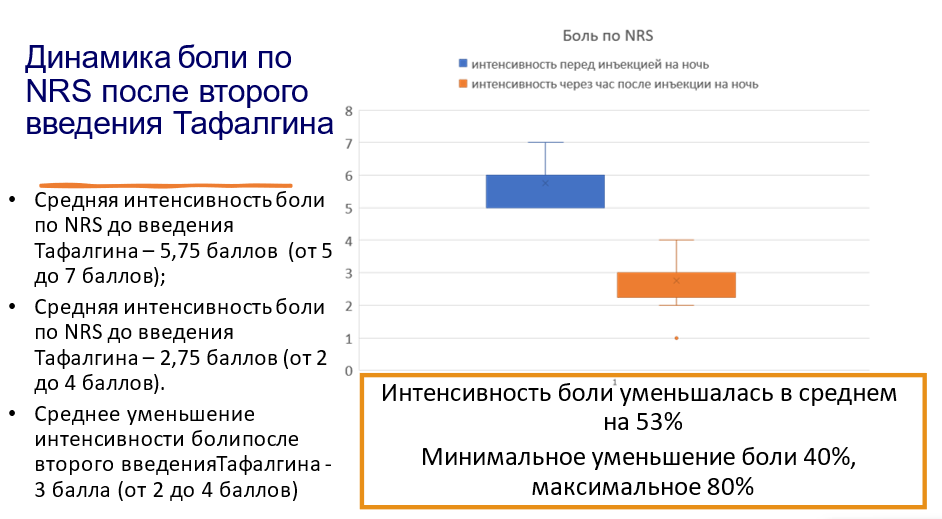
Второе введение «Тафалгина» (4 мг п/к) на ночь пациентам со средним уровнем боли 5,8 балла по шкале NRS (от 5 до 7 баллов) приводило к снижению интенсивности болевого синдрома на приблизительно 53%, т. е. средний балл по шкале NRS оказался равным 2,8 балла.
Таким образом, наш опыт показывает, что новый пептидный анальгетик «Тафалгин», раствор для подкожного введения (ЗАО «ФармФирма „Сотекс”», Россия), может быть эффективным препаратом для послеоперационного обезболивания пациентов со средней и высокой интенсивностью болевого синдрома на фоне применения стандартной комбинации парацетамола и НПВС в рамках мультимодальной анальгезии.
«Тафалгин» может быть особенно полезным для тех пациентов, у кого из-за наличия абсолютных противопоказаний, технических сложностей или отказа от процедуры самим пациентом выполнение проводниковой или продленной эпидуральной анестезии оказывается невозможным, а также у пациентов с противопоказаниями или плохой переносимостью наркотических обезболивающих препаратов (полных агонистов опиоидных рецепторов) и у пациентов с риском развития привыкания или зависимости.
Карелов Алексей Евгеньевич – д. м. н., профессор кафедры анестезиологии и реаниматологии им. В. Л. Ваневского, руководитель Центра лечения боли ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И .И. Мечникова» Минздрава России, председатель комитета по лечению боли ФАР, г. Санкт-Петербург.

