
О том, как преодолеть разрыв между бизнесом и наукой и ускорить переход отечественной фармацевтической промышленности к инновационной модели развития, «Новостям GxP» рассказал Михаил Самсонов — медицинский директор «Р-Фарм», одной из немногих российских компаний, которая уже сегодня создает и выводит на рынок инновационные препараты.
Отраслевая дилемма
— Принятая стратегия «Фарма-2030» предполагает поэтапный переход от дженериковой к инновационной модели развития отрасли, в частности к созданию собственных линий разработки. Но для этого надо преодолеть разрыв между наукой и индустрией. Как должно быть выстроено сотрудничество в сфере исследований и разработок фармкомпаний с научными организациями?
— Стратегия «Фарма-2030» стала логичным продолжением стратегии «Фарма-2020», в которой был реализован, с одной стороны, комплекс мер по развитию производства дженериков и биоаналогов, с другой — инновационных препаратов. Производство дженериков — важная составляющая системы обеспечения здравоохранения качественными, уже понятными препаратами, которая позволяет отработать все технологические процессы, нарастить производственные мощности и создать фундамент для дальнейшего развития отрасли. Следующий шаг — полный цикл производства биологических препаратов, в котором все процессы сложнее, дольше и требуют масштабных инвестиций. Производство биологических препаратов, в свою очередь, служит отличной базой для отработки новых компетенций и технологий в области аналитики, доклинических и клинических исследований, регуляторных диалогов. Это мостик для перехода к следующей стадии — разработке инновационных препаратов.
Взаимодействие науки и бизнеса — сложная тема для фармкомпаний в большинстве стран мира. Задачи и оценка результатов у фундаментальной, прикладной науки и бизнеса существенно различаются. Если у фарминдустрии есть понятный и четкий заказ со стороны системы здравоохранения, то у академических учреждений, особенно фундаментальных, задачей исследования может быть научный поиск с большим отрывом от жизни. Поэтому в своей работе мы используем два формата сотрудничества с научными институтами. Первый — выстраивание диалога с клиническими научными учреждениями, ведущими институтами и органами власти по вопросам показаний для инновационного препарата, оценки востребованности для пациентов, то есть клинико-научная экспертиза наших разработок. Второй формат — это поиск терапевтических мишеней в фундаментальных исследованиях, оценка новых открытий, изучение механизмов возникновения патологий, их генетической причины. По этим схемам мы работаем в таких областях, как онкология, аутоиммунные заболевания, кардиология.
Одним из ярких примеров нашего взаимодействия с научными организациями является сотрудничество с ФГБУ «НМИЦ им. В. А. Алмазова» как в части клинических исследований, так и в реализации более сложных проектов — поиске терапевтических мишеней и кандидатных препаратов. Много сотрудничаем с Сеченовским университетом, НМИЦ кардиологии им. Е. И. Чазова, ведущими онкологическими учреждениями, Казанским федеральным университетом. Во многих проектах мы выступаем в качестве индустриального партнера и можем участвовать как прямой соинвестор или нести затраты на организацию производства, например, небольшой партии биологических препаратов.
мы, как крупнейшая российская фармацевтическая компания, БОЛЬШИНСТВО ЗАДАЧ по исследованиям и разработкам решаем сами
— Какие шаги со стороны регулятора могли бы ускорить процесс выведения на российский рынок новых препаратов? Использует ли ваша компания механизмы государственной поддержки?
— Мы, как крупнейшая российская фармацевтическая компания, большинство задач по исследованиям и разработкам решаем сами. У нас есть собственная И&Б-лаборатория в Пущинском научном центре, где мы занимаемся именно инновационными разработками. Но государственная поддержка, безусловно, важна и нужна, в том числе для того, чтобы сбалансированно и быстро вывести в клинику инновационные разработки, при этом получив достаточный и комфортный объем доказательств эффективности и безопасности нового препарата как для нас, так и для регулятора.
Многое уже сделано в этом направлении. В последние два года значительно изменилось законодательство в рамках ЕАЭС, есть механизм ускоренной регистрации. Вместе с тем важно продолжить развитие интенсивного научного консультирования, в первую очередь с ведущими регуляторными институтами. Конечно, есть механизм письменной консультации, и при правильной формулировке вопроса вам дадут конкретные ответы. Но в большинстве регуляторных агентств мира существует возможность очной встречи с консультантами и экспертами. На мой взгляд, нужны не просто консультации, а системный открытый диалог как с регуляторами, так и с научными академическими институтами, чтобы обсуждать дизайн исследований, применение данных реальной клинической практики, методологию регистрационных исследований. У нас есть прекрасные примеры активного сотрудничества и совместной экспертизы по вопросам CAR-T-клеточной технологии с НМИЦ ДГОИ им. Дмитрия Рогачева, Центром гематологии, ФГБУ «ЦЭККМП» Минздрава России.
Круг интересов
— Сколько собственных препаратов, оригинальных и воспроизведенных биологических, сейчас в портфеле группы «Р-Фарм»? Какие терапевтические направления являются приоритетными? С какой стадии «Р-Фарм» ведет разработки?
— Шесть наших собственных препаратов находятся на стадии ранней разработки и доклинических исследований, пять — на стадии клинических исследований. У нас отличная динамика по клиническим исследованиям.
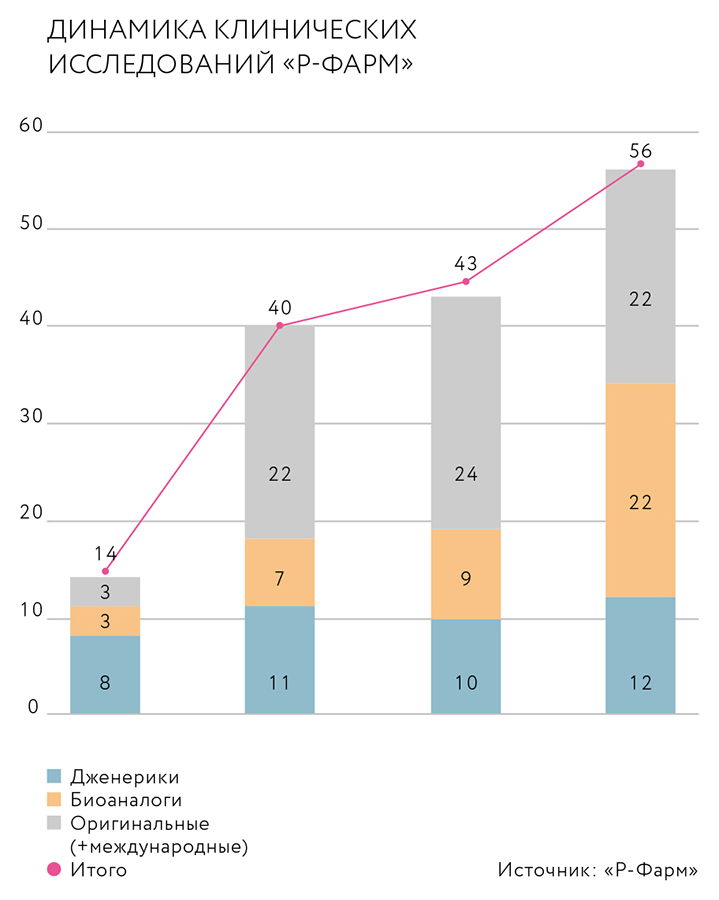
Традиционные для нашей компании направления — онкология и вирусология. В вирусологии прежде всего работаем с гепатитом С. Сейчас у нас идет исследование и стартует подготовка к регистрации препарата, применяющегося при раке простаты. Также идут испытания очень востребованной, но сложной разработки для лечения рака желудка. Еще одно большое направление, связанное с применением наших ингибиторов интерлейкинов ИЛ-6 и ИЛ-1, — аутовоспалительные заболевания и ревматология. Аутовоспаление наряду с кардиологией относится к трендам современной фарминдустрии. Терапия кардиологических заболеваний находится на новом витке понимания научных возможностей, накопились новые данные, в том числе связанные с последствиями COVID-19. Традиционно кардиология считалась дженериковой нозологией, но сейчас появились препараты на основе мРНК и миРНК для терапии гипертонии и гиперлипидемии и целый ряд инновационных подходов к лечению.
Нам также интересны нейродегенеративные заболевания, в том числе болезнь Паркинсона и болезнь Альцгеймера.
Сейчас у нас в портфеле около 20 биологических препаратов, из которых три уже зарегистрированы, в том числе пембролизумаб и два партнерских (бевацизумаб и ритуксимаб). Это наш совместный проект с компанией Dr. Reddy’s, в рамках которого мы локализуем производство по полному циклу на наших площадках в Ярославле и Москве. Dr. Reddy’s — это известная фармкомпания с большими международными амбициями. Наше сотрудничество носит двусторонний характер: индийские партнеры проводят клиническое исследование и регистрируют наш препарат для терапии ревматоидного артрита олокизумаб в Индии.
Открытый диалог
— Сколько в настоящее время проходит клинических исследований при поддержке «Р-Фарм»? Увеличилось ли их количество по сравнению с прошлым, позапрошлым годами?
— Число исследований существенно возросло, причем значительную часть занимают исследования биоэквивалентности для дженериков. В прошлом году мы были компанией номер один по числу полученных разрешений на проведение таких исследований. Сейчас у нас в среднем проходит 30 исследований биоэквивалентности в год и еще восемь-девять исследований биоаналогов — как первая, так и третья фаза.
Мы всегда были открыты к партнерству и сейчас примерно 50% работ выполняем в сотрудничестве с ведущими исследовательскими площадками, такими как университет «Сириус», Центр клинических исследований Сеченовского университета и многие другие. Это позволяет нам оптимизировать процесс разработки и нагрузку на собственную исследовательскую инфраструктуру.
Мы продолжаем активную работу по проведению международных исследований, поскольку одним из приоритетов компании является выход на внешние рынки. Например, мы реализовали огромную программу исследований ингибитора интерлейкина-6 олокизумаба CREDO в 19 странах мира, в ней приняли участие 2,5 тыс. пациентов. Сегодня препарат зарегистрирован уже в пяти странах, идет процесс регистрации во Вьетнаме, Турции, ОАЭ.
нам интересны НЕЙРОДЕГЕНЕРАТИВНЫЕ заболевания, в том числе болезнь Паркинсона и болезнь Альцгеймера
Сейчас мы перестраиваем свою работу на внешних рынках, двигаемся в сторону Юго-Восточной Азии, традиционно работаем и регистрируем препараты в Латинской Америке. Со времен пандемии COVID-19 у нас есть понимание рынка и знание нашей компании регуляторами Персидского залива — наш завод в Ярославле стал единственной российской площадкой, получившей лицензию SFDA. В Саудовской Аравии и ОАЭ довольно много моногенных и аутовоспалительных заболеваний, поэтому мы активно регистрируем наши препараты в этом регионе.
— Только что получил регистрационное удостоверение оригинальный препарат «Р-Фарм» гофликицепт, он зарегистрирован по показанию «идиопатический рецидивирующий перикардит». Почему вы выбрали именно эту нозологию? Гофликицепт разработан специалистами «Р-Фарм» с нуля? Предполагаете ли вы регистрировать другие показания для гофликицепта?
— Гофликицепт — это наш собственный оригинальный препарат, разработанный в наших лабораториях с нуля, с концепции по мишени и клеточной линии, в 20132014 годах. Ковидный период, с одной стороны, несколько затормозил работы по проекту, в сроках регистрации мы пару лет потеряли, с другой — показал нам новые перспективы и возможности для применения препарата. Стало ясно, что воспаление играет важную роль в поражении эндотелия, атеросклерозе, тромбоэмболиях и перикардите. Мы поддерживаем сейчас две исследовательские программы по изучению влияния коронавирусной инфекции на развитие перикардита с особым фокусом на больных с коморбидностью.
Гофликицепт разработан для лечения заболеваний, в патогенезе которых ин-терлейкин-1 играет ключевую роль, в том числе характеризующихся системным воспалением. Интерлейкин-1 активно участвует в процессе воспаления — например, он вырабатывается при реакции на инфекцию. В большинстве случаев такая реакция является правильной для нашего организма, но иногда она становится избыточной и вызывает серьезное заболевание. С момента разработки препарата мы видели его перспективы в огромном пуле заболеваний, связанных с активацией воспаления, с активацией интерлейки-на-1. Исследования и регистрация гофликицепта — пример нашего сотрудничества с ФГБУ «НМИЦ им. В. А. Алмазова». Нам удалось объединить компетенции ревматологов и кардиологов и провести масштабные исследования по лечению идиопатического рецидивирующего перикардита. Мы начали их в 2019 году, незадолго до пандемии. В такое сложное время мы обеспечили пациентам, участвующим в исследованиях, безопасность, снимали при необходимости жилье в Санкт-Петербурге, чтобы продолжить совместную работу. По итогам нашего трехлетнего наблюдения за пациентами мы подготовили большую статью в журнале, читая которую понимаешь, зачем нужно было пройти такой длинный и сложный путь.
гофликицепт проходит ИСПЫТАНИЯ при семейной средиземноморской лихорадке и инфаркте миокарда
Сейчас два наших препарата, гофликицепт и олокизумаб, проходят клинические испытания для расширения показаний. Так, гофликицепт проходит испытания при семейной средиземноморской лихорадке и инфаркте миокарда. Согласно нашим результатам, препарат снижает системное воспаление у пациентов с инфарктом, перенесших стентирование.
Олокизумаб исследуется у пациентов с идиопатическим легочным фиброзом и у детей с ювенильным идиопатическим артритом — первые данные по педиатрическому исследованию, которое проводится совместно с рядом ведущих педиатрических клиник РФ, мы уже получили.

