Надлежащая производственная практика (GMP) представляет собой составную часть системы обеспечения качества лекарственных средств (ЛС), без которой невозможно современное фармацевтическое производство.
Правилами GMP регулируются такие вопросы, как предотвращение загрязнений, соблюдение обязательств, заявленных при регистрации ЛС (соблюдение состава, технологии, оценка рисков, стратегия контроля, управление изменениями и т.п.) [1]. В 2015 году в силу вступили требования Приказа МЗ РК «Об утверждении надлежащих производственных практик» от 27 мая 2015 года № 392 (Приложение 3) [2]. Для производства ЛС, предназначенных для обращения на общем рынке Евразийского экономического союза, действует Решение Коллегии Евразийской экономической комиссии (ЕЭК) «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза» от 03 ноября 2016 года № 77 (Приложение 15) [3-4].
Неотъемлемой частью GMP является валидация производственных процессов, подтверждающая их постоянство при выпуске ЛС независимо от серии, для каждой единицы лекарственной формы и упаковки. В настоящее время фармацевтическими предприятиями государств-членов ЕАЭС используется обновленная версия рекомендаций ЕЭК «О руководстве по валидации процесса производства лекарственных препаратов для медицинского применения» № 19 [5].
На основе указанных выше нормативных документов нами проведена валидация полного цикла производства лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг». Исследования по валидации производственного процесса осуществлялись на производственной площадке ТОО «Абди Ибрахим Глобал Фарм» (Республика Казахстан). Валидация проводилась в связи с увеличением размера серии, предполагаемого в дальнейшем для рутинного производства лекарственного препарата на данной производственной площадке.
Материалы и методы исследования
Исследования проводили с использованием Промышленного технологического регламента лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг» ТР-0029 на серию объемом 360 000 таблеток, на основании которого были установлены оптимальные значения критических параметров технологического процесса. Оценку качества субстанций для фармацевтического применения (активная субстанция и вспомогательные вещества) и лекарственного препарата осуществляли на основании требований и положений Фармакопеи ЕАЭС, Государственной фармакопеи Республики Казахстан (ГФ РК) и основных фармакопей мира, с которыми они гармонизированы (Европейской фармакопеи, Британской фармакопеи, Фармакопеи США), а также спецификаций качества сырья и исходных материалов, промежуточных продуктов и готового продукта.
В технологическом процессе использовали активную фармацевтическую субстанцию – метформина гидрохлорид и вспомогательные вещества – гидроксипропилцеллюлозу, магния стеарат, гипромеллозу, полиэтиленгликоль, титана диоксид.
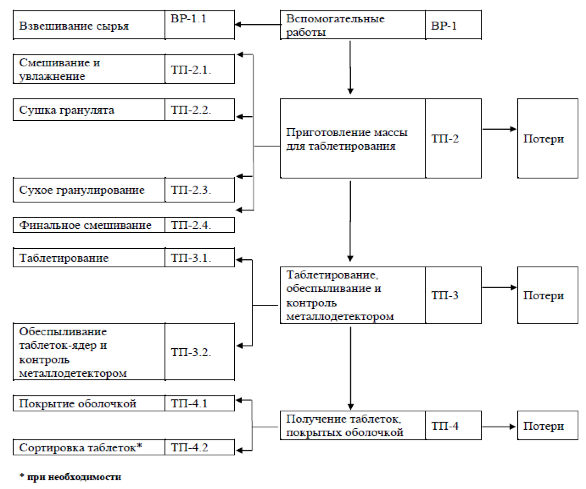
Технологический процесс производства представлен на рисунке 1 и состоит из следующих стадий: взвешивание сырья, смешивание и увлажнение, сушка гранулята, сухое гранулирование, финальное смешивание, таблетирование с обязательным контролем с помощью металлодетектора и покрытие оболочкой.
Взвешенные ингредиенты (метформина гидрохлорид и гидроксипропилцеллюлоза) загружаются в миксер, где происходит их смешивание. По окончании времени перемешивания добавляется увлажнитель (вода очищенная), после чего масса должна быть перемешана. Полученный влажный гранулят подвергают сушке в псевдоожиженном слое. Далее идет процесс сухого гранулирования, который осуществляется на мельнице. Финальное смешивание полученной массы и магния стеарата (скользящее вещество) производится в миксере. Готовую массу подвергают таблетированию на таблет-прессе, функционирующем в комплексе с обеспылевателем и металлодетектором.
Процесс покрытия оболочкой таблеток-ядер начинается с подготовки раствора для покрытия путем смешивания вспомогательных веществ (гипромеллозы, полиэтиленгликоля, титана диоксида и воды очищенной). Процесс производится в аппарате для нанесения оболочки.
Оборудование, используемое в процессе производства таблеток (таблица 1), имеет подтвержденный статус квалификации.
Таблица 1 – Перечень оборудования для производства лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг»
| № | Наименование оборудования | Квалификация | |
| IQ протокол | OQ протокол | ||
| 1 | Аппарат для нанесения оболочки | √ | √ |
| 2 | Аппарат для сушки в псевдоожиженном слое | √ | √ |
| 3 | Мельница | √ | √ |
| 4 | Металлодетектор | √ | √ |
| 5 | Миксер | √ | √ |
| 6 | Миксер биновый | √ | √ |
| 7 | Таблетировочный пресс | √ | √ |
Валидацию технологического процесса проводили на 3 последовательных промышленных сериях лекарственного препарата с номерами 3861119, 3871119, 3881119. Испытания промежуточных продуктов и готовой продукции по установленным показателям качества осуществляли с использованием соответствующего аналитического оборудования: прибора для определения влажности, ситовой вибрационной просеивающей машины, прибора для определения насыпной плотности, прибора для определения сыпучести, аналитических весов, прибора для определения распадаемости, прибора для определения истираемости, прибора для определения твердости, прибора для определения растворения, высокоэффективного жидкостного хроматографа, спектрофотометра. Применяемые аналитические приборы имели подтвержденный статус квалификации и подвергались поверке с установленной периодичностью. Испытания проводили с использованием валидированных методик.
Рисунок 1 – Технологическая схема процесса производства лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг»
Результаты и обсуждение
Для проведения валидации необходимо установление критических стадий процесса производства данного лекарственного препарата. Определение таких стадий осуществляется на основании оценки рисков для качества лекарственного препарата. В результате к критическим стадиям технологического процесса нами были отнесены следующие:
- смешивание и увлажнение ингредиентов;
- сушка гранулята;
- сухое гранулирование;
- финальное смешивание для получения таблеточной массы;
- таблетирование;
- покрытие оболочкой.
На стадии смешивания и увлажнения ингредиентов, как правило, задают и контролируют следующие технологические параметры – время смешивания, и скорость вращения миксера (50‑70 об/мин).
На данной стадии качество промежуточного продукта оценивали по показателям «Описание» и «Потеря в массе при высушивании», критерии приемлемости которых приведены в таблице 2. Образцы отбирали с 6 мест по 2 сверху (места отбора В), с середины (места отбора С) и низа (места отбора Н) используемого оборудования в количестве 5 г с одной пробы.
Таблица 2 – Показатели качества на стадиях смешивания и увлажнения ингредиентов, сушки гранулята при валидации технологического процесса лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг»
| Показатели качества | Критерий приемлемости | Количество мест отбора | Общее количество проб | Масса проб (г) |
| Описание | Порошок белого или почти белого цвета | 6
(В1, В3; С2, С3; Н1, Н4) |
1х6 = 6 | 5х6 = 30 |
| Потеря в массе при высушивании (%) | Стадия смешивания и увлажнения ингредиентов:
3,5 – 8,5 Стадия сушки гранулята: 0,5 – 3,0 |
Результаты испытания по приведенным выше показателям качества, полученные на стадии смешивания и увлажнения ингредиентов, отражены в таблице 3. Как видно, независимо от места отбора результаты испытания соответствуют допустимым пределам, установленным в спецификации внутрипроизводственного контроля качества по данному показателю. Это подтверждает, что процесс смешивания и увлажнения ингредиентов осуществлен равномерно, в результате чего получена однородная масса белого цвета с правильным распределением увлажнителя.
Таблица 3 – Результаты испытания по показателю качества «Потеря в массе при высушивании» на стадии смешивания и увлажнения ингредиентов (1) и сушки гранулята (2)
| Место отбора | Серия | |||||
| 3861119 | 3871119 | 3881119 | ||||
| 1 | 2 | 1 | 2 | 1 | 2 | |
| В1 | 5,0 | 0,83 | 4,7 | 0,78 | 5,2 | 1,1 |
| В3 | 4,6 | 0,78 | 4,7 | 0,79 | 4,7 | 0,95 |
| С2 | 4,3 | 0,96 | 4,6 | 0,73 | 4,7 | 1,2 |
| С3 | 4,0 | 1,1 | 4,8 | 0,91 | 4,4 | 1,1 |
| Н1 | 4,1 | 1,2 | 4,5 | 1,2 | 4,7 | 1,1 |
| Н4 | 4,4 | 1,4 | 4,5 | 1,2 | 4,9 | 1,1 |
На стадии сушки гранулята обычно задают и контролируют следующие технологические параметры – температура и время сушки. Оптимальное значение температуры составляло 40±5 °С, для определения времени сушки ориентировались на показатель «Потеря в массе при высушивании».
На данной стадии оценку качества промежуточного продукта и отбор проб осуществляли аналогичным образом, что и на стадии смешивания и увлажнения ингредиентов (таблица 2).
Результаты испытания по показателю «Потеря в массе при высушивании», полученные на стадии сушки гранулята (таблица 3), находятся в пределах, установленных спецификацией, и доказывают корректность проведения данной технологической стадии.
На стадии сухого гранулирования контролируют размер частиц гранулята с использованием ситовой вибрационной просеивающей машины. Оптимальный размер отверстий сита составляет 3,0 мм.
На данной стадии контроль качества промежуточного продукта проводили по показателям «Описание» и «Размер частиц», критерии приемлемости которых приведены в таблице 4. В отличие от предыдущих стадий отбор образцов для испытаний зависит от определяемого показателя качества. Для показателя «Описание» образцы отбирали с 6 мест по 2 сверху, с середины и низа, а для показателя «Размер частиц» – с 10 мест по 3 сверху, 3 с середины и 4 с низа используемого оборудования, объединяя 3 образца (верх, середина, низ) по 25 г.
Таблица 4 – Показатели качества на стадии сухого гранулирования при валидации технологического процесса лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг»
| Показатели качества | Критерий приемлемости | Количество мест отбора | Общее количество проб | Масса проб (г) |
| Описание | Порошок белого или почти белого цвета | 6
(В1, В3, С2, С3, Н1, Н4) |
1х6 = 6 | 5х6 = 30 |
| Размер частиц (ситовой анализ) (мкм) | Фактические данные | 10
(В1, В2, В3, С1, С2,С3, Н1,Н2, Н3, Н4) |
3 | 25х3 = 75 |
Стадия финального смешивания контролируется с помощью единственного параметра – времени перемешивания.
Спецификация промежуточного продукта, полученного на данной стадии, включала следующие показатели: «Насыпная плотность», «Сыпучесть», «Потеря в массе при высушивании», «Однородность содержания» (таблица 5).
Отбор образцов для испытаний проводили по следующей схеме: «Насыпная плотность» – с 10 мест по 3 сверху, 3 с середины и 4 с низа используемого оборудования в количестве 20 г с одной пробы (3 объединенные пробы); «Сыпучесть» – с 10 мест по 3 сверху, 3 с середины и 4 с низа используемого оборудования в количестве 90 г с одной пробы (3 объединенные пробы); «Потеря в массе при высушивании» – с 6 мест по 2 сверху, с середины и низа используемого оборудования в количестве 5 г с одной пробы; «Однородность содержания» – с 10 мест по 3 сверху, 3 с середины и 4 с низа используемого оборудования в количестве 5 г с одной пробы.
Таблица 5 – Показатели качества на стадии финального смешивания при валидации технологического процесса лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг»
| Показатели качества | Критерий приемлемости | Количество мест отбора | Общее количество проб | Масса проб (г) |
| Насыпная плотность (г/мл) | 0,500 – 0,900 | 10
(В1, В2, В3, С1, С2, С3, Н1, Н2, Н3, Н4) |
1х1 = 10 | 20х10 = 200 |
| Сыпучесть (с/100 г) | Фактические данные | |||
| Потеря в массе при высушивании (%) | 0,5 – 3,0 | 6
(В1, В3, С2, С3, Н1, Н4) |
1х6 = 6 | 5х6 = 30 |
| Однородность содержания (%) | 95,0 – 105,0 | 10
(В1, В2, В3, С1, С2, С3, Н1, Н2, Н3, Н4) |
1х10 = 10 | 5х10 = 50 |
Результаты испытаний, полученные на стадии финального смешивания, представлены в таблицах 6 и 7.
Таблица 6 – Результаты испытания по показателю качества «Сыпучесть» на стадии финального смешивания
| Количество мест отбора | Размер выходного отверстия насадки (мм) | Масса гранул (г) | Сыпучесть (с/100 г) |
| 1 (с 10 мест) | 25 | 100,00 | Свободная сыпучесть не наблюдается |
| 15 | 100,00 | — | |
| 10 | 100,00 | — |
Полученные результаты испытаний соответствует допустимым пределам, установленным спецификацией промежуточного продукта, что свидетельствует о получении таблеточной массы надлежащего качества.
Стадию таблетирования осуществляли со средней скоростью 56 000 табл./ч. Качество полученных таблеток-ядер контролировали в соответствии со спецификацией, которая включала показатели, характерные для твердой дозированной лекарственной формы. К ним относятся «Описание», Толщина», «Диаметр», «Средняя масса и однородность массы», «Истираемость», «Твердость», «Распадаемость», «Растворение», «Однородность дозированных единиц», «Количественное определение». Последние три показателя качества связаны с основной характеристикой лекарственного препарата – эффективность. Критерии приемлемости показателей качества для таблеток-ядер (таблица 8) соответствовали требованиям общих фармакопейных статей (монографий) ГФ РК и Фармакопеи США.
Таблица 7 – Результаты испытания по показателям качества «Насыпная плотность», «Потеря в массе при высушивании» и «Однородность содержания» на стадии финального смешивания
| Показатель качества | Серия | ||
| 3861119 | 3871119 | 3881119 | |
| Насыпная плотность (г/мл) | 0,539 | 0,683 | 0,612 |
| Потеря в массе при высушивании (среднее значение) (%) | 1,5 | 1,2 | 1,1 |
| Однородность содержания (среднее значение) (%)
|
100,1 | 97,7 | 98,0 |
Схема отбора образцов определялась индивидуально для каждого показателя качества с целью обеспечения репрезентативности образцов: «Растворение» – с 6 мест в количестве 2 таблетки-ядра с одной пробы, «Однородность дозированных единиц» – с 6 мест в количестве 4 таблетки-ядра с одной пробы, «Количественное определение» – с 6 мест в количестве 7 таблеток-ядер с одной пробы, во всех остальных случаях – с 6 мест в количестве 56 таблеток-ядер с одной пробы.
Таблица 8 – Показатели качества таблеток-ядер при валидации технологического процесса лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг» (количество мест отбора образцов 6)
| Показатели качества | Критерий приемлемости | Общее количество испытуемых таблеток-ядер |
| Описание | Таблетки-ядра белого цвета, круглые, с двояковыпуклой поверхностью | 56х6 = 336 |
| Толщина (мм) | 6,5 – 7,5 | |
| Диаметр (мм) | 13,5 – 14,5 | |
| Средняя масса (мг) | 1064,0 ± 5 % (1010,8 – 1117,2) | |
| Однородность массы (%) | Отклонение от средней массы допускается у 18 из 20 таблеток-ядер не более ± 5 %, у 2 из 20 таблеток-ядер – не более ± 10 % | |
| Истираемость (%) | Не более 1 | |
| Твердость (Н) | Не менее 70 | |
| Распадаемость (мин) | Не более 15 | |
| Растворение (%/45 мин) | Не менее 75 | 2х6 = 12 |
| Однородность дозированных единиц (%) | AV не более 15,0 | 4х6 = 24 |
| Количественное определение (мг/табл.) | 950,0 – 1050,0 (95,0 – 105,0 %) | 7х6 = 42 |
Все полученные образцы соответствовали приведенному выше описанию. Толщина и диаметр таблеток-ядер со всех точек отбора проявляли максимальную близость значений, составляя 6,6-7,1 мм по толщине, а значения диаметра были идентичны для всех трех серий в каждой точке отбора и равны 14,0 мм. Истираемость таблеток-ядер не превышала фармакопейных норм (не более 1 %), достигая всего 0,1-0,2 %. Время распада таблеток-ядер варьировало в диапазоне 11-12 мин для всех трех серий. Результаты по остальным показателям качества представлены в таблицах 9-10.
Таблица 9 – Результаты испытаний по показателям качества «Средняя масса и однородность массы», «Твердость» и «Растворение» таблеток-ядер
| Места отбора | Средняя масса (мг) | Отклонение от средней массы (%) | Твердость (Н) | Растворение (%/45 мин) |
|
Серия 3861119 |
||||
| 1 | 1072,4 | -1,9 +1,6 | 142,7 | 96,5 |
| 2 | 1077,6 | -1,3 +1,2 | 159,6 | 97,7 |
| 3 | 1102,1 | -1,7 +1,4 | 144,4 | 95,8 |
| 4 | 1091,3 | -2,0 +2,3 | 163,5 | 98,6 |
| 5 | 1073,5 | -2,4 +1,7 | 148,2 | 98,4 |
| 6 | 1076,7 | -1,6 +2,5 | 137,7 | 98,3 |
| 7 | 1079,6 | -1,9 +1,5 | 139,7 | — |
| 8 | 1087,1 | -3,4 +2,7 | 154,7 | — |
|
Серия 3871119 |
||||
| 1 | 1084,9 | -1,3 +1,0 | 149,6 | 90,3 |
| 2 | 1067,6 | -1,4 +1,9 | 117,7 | 94,2 |
| 3 | 1087,8 | -1,1 +1,1 | 117,3 | 94,9 |
| 4 | 1075,9 | -1,3 +2,2 | 142,3 | 93,3 |
| 5 | 1075,9 | -1,1 +2,0 | 143,6 | 96,0 |
| 6 | 1086,1 | -1,3 +1,6 | 137,2 | 94,6 |
| 7 | 1078,9 | -1,3 +1,2 | 116,7 | — |
| 8 | 1064,5 | -1,8 +4,0 | 96,5 | — |
|
Серия 3881119 |
||||
| 1 | 1066,1 | -1,6 +2,0 | 130,1 | 95,5 |
| 2 | 1078,7 | -1,2 +1,8 | 105,6 | 98,4 |
| 3 | 1080,8 | -1,5 +2,4 | 128,4 | 101,2 |
| 4 | 1077,6 | -1,2 +1,6 | 101,0 | 94,8 |
| 5 | 1068,0 | -1,7 +2,5 | 95,5 | 93,6 |
| 6 | 1080,4 | -1,5 +1,4 | 123,7 | 96,0 |
| 7 | 1075,0 | -1,1 +1,5 | 132,5 | — |
| 8 | 1070,1 | -1,1 +2,9 | 116,5 | — |
Таким образом, представленные результаты испытаний таблеток-ядер соответствуют фармакопейным критериям приемлемости, что доказывает постоянство их качества независимо от места отбора образцов и серии промежуточного продукта.
В дальнейшем полученные таблетки-ядра подвергали покрытию пленочной оболочкой, позволяющей облегчить пациенту прием внутрь (перорально) лекарственного препарата. Для проведения стадии покрытия были заданы и контролировались следующие технологические параметры с соответствующими оптимальными значениями: температура подаваемого воздуха – 70-90 оС, скорость насоса – 6-12 об/мин, скорость барабана – 1-8 об/ мин, давление распыления – 0,1-0,5 мБар.
Качество таблеток, покрытых оболочкой, оценивали по тем же показателям, что и для таблеток-ядер, однако по ряду отдельных показателей имеется различие в критериях приемлемости. Допустимые нормы отклонения показателей «Средняя масса» и «Распадаемость» с учетом произведенной стадии покрытия оболочкой изменены до значений 1090,0 мг ± 5 % и 30 мин, соответственно. Отличительными для данной стадии представляются показатели качества «Микробиологическая чистота» и «Родственные примеси», влияющие на безопасность производимого лекарственного препарата. Критерии приемлемости для первого из них определяются соответствием фармакопейным требованиям, а для второго показателя – заданному предельному содержанию примесей: примесь А – не более 0,02 %; любая другая примесь – не более 0,5 %; сумма примесей – не более 1,0 %.
Таблица 10 – Результаты испытаний по показателям качества «Однородность дозированных единиц» и «Количественное определение» таблеток-ядер
| Серия
Результаты испытания |
3861119 | 3871119 | 3881119 |
|
Количественное определение |
|||
| Среднее значение (мг/табл.) | 1029,7 | 1015,1 | 977,2 |
|
Однородность дозированных единиц |
|||
| Среднее значение (%) | 103,0 | 101,2 | 97,7 |
| Стандартное отклонение (%) | 0,8 | 1,4 | 0,8 |
| Относительное стандартное отклонение (%) | 0,8 | 1,4 | 0,8 |
| Доверительный интервал AV (%) | 2,6 | 3,3 | 2,7 |
Для испытаний по необходимым показателям качества отбор образцов осуществляли следующим образом: «Описание», «Средняя масса и однородность массы», «Толщина», «Диаметр», «Распадаемость» – с 6 мест в количестве 20 таблеток с одной пробы; «Идентификация» (действующее вещество – метформин, краситель – титана диоксид), «Родственные примеси», «Однородность дозированных единиц», «Растворение», «Количественное определение» – с 6 мест в количестве 10 таблеток с одной пробы; «Микробиологическая чистота» – с 3 мест в количестве 10 таблеток с одной пробы.
Результаты испытаний по указанным выше показателям качества, полученные на стадии покрытия оболочкой, соответствовали критериям приемлемости, установленным в спецификации готового продукта. Полученные результаты доказывают рациональность подобранной схемы отбора образцов для испытаний на данной стадии, а главное, однородность качества готовой продукции независимо от валидационных серий, для каждой единицы лекарственной формы.
Результаты испытаний включены в отчет фармацевтического предприятия о валидации технологического процесса производства лекарственного препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг».
Выводы
Проведена валидация технологического процесса препарата «Глюконил®, таблетки, покрытые оболочкой, 1000 мг». Для каждой критической стадии процесса определены оптимальные параметры технологического процесса, установлен перечень контролируемых показателей качества, влияющих на безопасность и эффективность лекарственного препарата, и критерии их приемлемости, разработана рациональная схема отбора образцов, обеспечивающая их репрезентативность. Результаты, полученные при производстве трех промышленных валидационных серий, доказывают постоянство и надежность процесса производства лекарственного препарата от серии к серии и для каждой единицы дозированной лекарственной формы.
Авторы: Сакипова З.Б, Тулегенова А.У., Браташова А.Ю. / НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова», РГП на ПХВ «Национальный центр экспертизы лекарственных средств и медицинских изделий» Министерства здравоохранения Республики Казахстан.





