В сфере разработки лекарственных средств самой оптимальной и продуктивной является стратегия дизайна, основанного на аналоге (англ. analog—based design), чаще всего реализуемая в контексте создания инновационных лекарственных препаратов категории «следующие в классе». Яркие образцы применения этой стратегии демонстрирует в последние годы наука и индустрия Китайской Народной Республики.
 Автор: Константин Валерьевич Балакин, д. х. н., руководитель направления разработки инновационных лекарственных средств ООО «НИИ „ХимРар”», в. н. с. Московского физико-технического института (Национального исследовательского университета)
Автор: Константин Валерьевич Балакин, д. х. н., руководитель направления разработки инновационных лекарственных средств ООО «НИИ „ХимРар”», в. н. с. Московского физико-технического института (Национального исследовательского университета)
Большинство современных инновационных лекарственных соединений являются не новыми молекулярными конструкциями, а модифицированными аналогами уже известных структур. Это связано с тем, что дизайн, основанный на аналоге (ДОА; англ. analog-based design), является наиболее оптимальной стратегией поиска новых лекарственных кандидатов по времени, ресурсам и компетенциям. Так, анализ клинических лекарственных кандидатов, информация о которых публиковалась в Journal of Medicinal Chemistry ACS, показал, что не менее 56% из них были созданы при помощи ДОА1. Очевидно, что в это престижное издание попадают описания далеко не всех лекарственных кандидатов, особенно разработанных за пределами США, полученных при помощи этого весьма простого с точки зрения современной медицинской химии подхода. По нашей оценке, не менее 90% всех инновационных лекарственных средств, совокупно одобряемых в настоящее время национальными регуляторными ведомствами, получены с использованием ДОА.
Современная индустриальная практика такова, что перспективные новые хемотипы, впервые проявленные в виде препаратов категории «первые в классе» или дошедшие до продвинутых этапов клинических исследований, немедленно берутся в разработку многочисленными группами дизайнеров лекарств во всем мире, что приводит к быстрому появлению их модифицированных аналогов типа «следующие в классе». Наиболее успешные хемотипы эксплуатируются десятилетиями, что позволяет максимально реализовать заложенный в них потенциал. Пожалуй, наиболее масштабную и системную работу такого рода мы наблюдаем в последние годы в Китайской Народной Республике.
Опыт КНР в создании лекарств типа «следующие в классе»
Наука и индустрия КНР взяли на вооружение стратегию ДОА как эффективное средство достижения технологического суверенитета в сфере лекарственной разработки. Для иллюстрации этого тезиса в табл. 1 представлены низкомолекулярные лекарственные препараты категории «следующие в классе», зарегистрированные в КНР только в период с января по август 2023 года. Все указанные соединения являются близкими структурными аналогами известных западных лекарственных брендов.
Табл. 1. Низкомолекулярные лекарственные средства класса 1, зарегистрированные в КНР с января по август 2023 г., являющиеся аналогами типа «следующие в классе».
| Название | Компания | Дата регистрации в КНР | Биомишень, механизм действия | Индикации | Ближайшие аналоги (компания-разработчик, год) |
| Sunvozertinib | Dizal Pharma | 22.08.2023 | Ингибитор рецептора эпидермального фактора роста с мутацией в экзоне 20 (EGFRexon 20) | Терапия распространенного или метастатического НМРЛ с мутацией в экзоне 20 EGFR | Osimertinib (Astra Zeneca, 2015) |
| Vorolanib | Betta Pharmaceuticals | 07.06.2023 | Ингибитор рецепторных тирозиновых киназ PDGFR и VEGFR | Терапия почечно-клеточной карциномы (в комбинации с эверолимусом) | Sunitinib (Sugen, 2006) |
| Retagliptin | Jiangsu Hengrui Pharmaceuticals | 27.06.2023 | Ингибитор фермента дипептидил-пептидаза 4 (DPP4) | Лечение диабета типа 2 | Sitagliptin (Merck & Co., 2006) |
| Iruplinalkib | Qilu Pharmaceutical | 27.06.2023 | Ингибитор тирозиновых киназ ALK и ROS | Терапия ALK-положительного, распространенного или метастатического НМРЛ | Brigatinib (Ariad Pharmaceuticals, 2016) |
| Befotertinib Mesylate | Betta Pharmaceuticals | 29.05.2023 | Ингибитор рецепторной тирозиновой киназы EGFR с мутацией T790M | Терапия распространенного или метастатического НМРЛ с целевой мутацией T790MEGFR | Osimertinib (Astra Zeneca, 2015) |
| Alfosbuvir (SH229) | Sanhome Pharmaceutical | 12.05.2023 | Пангенотипичный ингибитор вирусной полимеразы HCVNS5B | Терапия хронического вирусного гепатита С (HCV) генотипов 1, 2, 3 или 6 в комбинации с даклатасвиром | Sofosbuvir (Gilead Sciences, 2013). Ключевой псевдонуклеозидный метаболит альфосбувира является полным аналогом софосбувира |
| Leritrelvir | Guangdong Raynovent Biotech | 23.03.2023 | Ингибитор протеазы 3CLкоронавируса SARS-CoV-2 | Терапия легких и умеренных форм COVID-19 | Nirmatrelvir (Pfizer, 2023) |
| Glumetinib | Shanghai Haihe Biopharma R&D Institute | 07.03.2023 | Ингибитор рецептора фактора роста гепатоцитов (c-Met) | Терапия распространенного или метастатического НМРЛ с мутацией в гене MET | Savolitinib (Astra Zeneca, 2021). Непрямой аналог |
| Keverprazan | Jiangsu Carephar Pharmaceutical | 14.02.2023 | Ингибитор связывания ионов калия с протонным насосом (H+, K+-АТФаза) в париетальных клетках желудка | Терапия кислотных поражений ЖКТ | Vonoprazan (Takeda, 2015) |
| Simnotrelvir | Simcere Pharmaceutical Group | 28.01.2023 | Ингибитор протеазы 3CLкоронавируса SARS-CoV-2 | Терапия легких и умеренных форм COVID-19 в комбинации с соединением Ritonavir | Nirmatrelvir (Pfizer, 2023). Активный компонент в комбинации с соединением Ritonavir |
| Deuremidevir (VV116) | Shanghai Vinnerna Biosciences | 28.01.2023 | РНК-зависимая РНК-полимераза коронавируса SARS-CoV-2 | Терапия легких и умеренных форм COVID-19 | Remdesivir (Gilead Sciences, 2020). Ключевой псевдонуклеозидный метаболит деуремидивира является прямым дейтерированным аналогом ремдесивира |
Национальное регуляторное ведомство КНР в соответствии с системой классификации лекарственных средств, принятой в 2020 году, не оперирует понятиями «первый/следующий в классе». Все новые лекарственные соединения, которые до момента регистрации не были одобрены в КНР или за ее пределами, за рядом исключений (например, индивидуальные оптические изомеры известных лекарственных соединений; пролекарства на основе сложных эфиров; новые солевые формы и др.), относятся к наивысшему по инновационности «классу 1», независимо от того, первое ли это соединение в данном структурно-функциональном ряду или очередной модифицированный аналог. Такая ситуация отражает современную ориентацию КНР на систематическую разработку и внедрение модифицированных аналогов уже известных лекарств.
Судя по результатам клинических исследований, новые китайские лекарства являются не просто функциональными копиями западных брендов. Реализованные в них структурные модификации в большинстве случаев позволяют улучшить фармакологический профиль прототипов-предшественников.
Аналоги осимертиниба
Одним из наиболее ярких примеров является разработка в КНР аналогов осимертиниба (рис. 1) – высокоэффективного лекарственного средства терапии немелкоклеточного рака легкого (НМРЛ), действующего по механизму ковалентного ингибирования мутантных форм рецептора EGFR2. Этот прорывной препарат, впервые одобренный в США в 2015 году, быстро стал монополистом на рынке Юго-Восточной Азии, заняв примерно 50% целевого клинического сегмента. Учитывая очень высокую стоимость лечения, установленную западным монополистом – около $13 000 за месячный курс3, такая ситуация легла тяжким бременем на систему здравоохранения КНР, где наблюдается один из самых высоких в мире уровней заболеваемости НМРЛ. В ответ китайская наука и индустрия предприняли энергичные и масштабные действия по созданию собственных модифицированных аналогов осимертиниба. В результате уже спустя два-три года появились первые клинические кандидаты, а затем и зарегистрированные препараты типа «следующие в классе» (рис. 1). Красным цветом выделены модифицированные фрагменты и атомы, составляющие отличие от осимертиниба. Очевидно, что отличия от прототипа в основном довольно незначительные. В дополнение к уже одобренным еще три препарата находятся на завершающих этапах исследований и регистрации в КНР (не показаны).
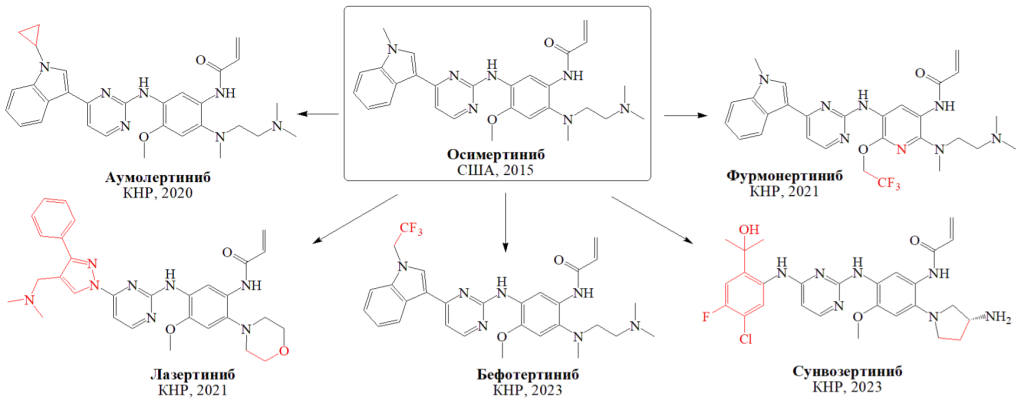
Пока трудно сказать, какие из китайских аналогов будут лучше, а какие слабее осимертиниба. Ответ на этот вопрос появится лишь в результате многолетнего опыта их реального применения. Но одно можно сказать уже сегодня: на данном этапе КНР преодолела технологическую и экономическую зависимость от западного монополиста в этом важнейшем сегменте национального здравоохранения.
Осимертиниб присутствует на рынке Российской Федерации с 2017 года, и с тех пор его ежегодные продажи неуклонно растут, приблизившись к 6 млрд рублей в 2022 году. Разработка и выведение на рынок инновационного аналога такого типа потребовали бы вложений на уровне 500 млн рублей. Легко подсчитать: если бы в России, подобно КНР, был реализован хотя бы один успешный проект по разработке аналогов осимертиниба, то к настоящему моменту страна сэкономила бы уже не один миллиард рублей, вместо того чтобы направлять их производителю из недружественного государства.
Дизайн «следующих в классе»: время, деньги и не только
Широкое применение стратегии ДОА для создания препаратов типа «следующие в классе» в мировой фарминдустрии обусловлено как задачами экономического характера (снижение рисков, длительности и удельной стоимости разработки лекарств), так и вопросами своевременного обеспечения лекарственной безопасности в экстренных ситуациях, таких как эпидемии новых опасных заболеваний, требующих быстрого реагирования.
Показательными являются примеры из области разработки средств терапии COVID-19 (табл. 1). Препараты первой волны, нацеленные на специфические мишени коронавируса SARS-CoV-2, начали получать первые ускоренные одобрения регуляторных ведомств в 2020-2022 годах. Примеры таких соединений – ремдесивир и нирматрелвир (США). Но уже в начале 2023 года в КНР были зарегистрированы их модифицированные аналоги – ренминдевир, ключевым метаболитом которого является дейтерированный аналог ремдесивира, а также симнотрелвир и леритрелвир, аналоги нирматрелвира. Следует обратить внимание именно на скорость появления указанных препаратов типа «следующие в классе», что характерно для подхода ДОА.
Еще одним фактором является «орфанизация» терапевтических индикаций на все более специализированные формы, связанные с мутантными вариантами биомишеней, участвующих в патогенезе заболеваний. Это находит выражение в статистике по орфанным лекарствам и заболеваниям: так, число лекарств, одобренных регуляторным ведомством США по орфанным индикациям, выросло с 14 в 2000 году до 77 в 2017 году, а число американцев, страдающих хотя бы одним орфанным заболеванием, приблизилось к 30 млн4. Для терапии таких заболеваний требуется конструирование лекарственных соединений, высокоселективно действующих на мутантные формы биомишеней, которые отличаются от предшественников зачастую лишь одной аминокислотой. В этой ситуации дизайн нового лекарственного соединения, основанный на аналоге, но включающий в себя этап тонкой настройки на заданную мутацию, является практически необходимым подходом5.
По разным причинам стратегия ДОА пока не слишком широко распространена в Российской Федерации. Однако в современной геополитической ситуации ее реализация позволит быстро и эффективно конструировать и внедрять необходимые нашей стране лекарственные соединения, тем самым снижая технологическую и экономическую зависимость от зарубежной фарминдустрии. Уместно напомнить, что Российская Федерация ежегодно импортирует лекарства на сумму более $20 млрд, причем преимущественно из недружественных стран.
- Brown D.G. // J Med Chem. 2023. Vol. 66. N 11. P. 7101-7139. doi 10.1021/acs.jmedchem.3c00521
- Lau S.C.M., Ou S.I. // J ThoracOncol. 2022. Vol. 17. N. 10. P. 1144-1154. doi 10.1016/j.jtho.2022.08.016
- AHRQ Healthcare Horizon Scanning System – Potential High-Impact Interventions Report Priority Area 02: Cancer (PDF). AHRQ. December 2015. Archived from the original(PDF) on 2017-04-30. Дата обращения: 17.10.2023.
- Fermaglich L. J., Miller K. L. // Orphanet J Rare Dis. 2023. V. 18. N. 163. doi: 10.1186/s13023-023-02790-7
- Dangi M., Khichi A., Jakhar R., Chhillar A. K. // Curr Pharm Biotechnol. 2021. Vol. 22. P. 1030-1045. doi10.2174/1389201021666200908121409


