Фокус на передовых лекарственных препаратах типа «первые в классе» является особенностью регистрационной политики ведущего в мире национального регулятора – FDA США. Однако при несомненной общей высокой инновационности продуктового портфеля FDA в нем, безусловно, доминируют лекарственные аналоги типа «следующие в классе».
 Автор: Константин Валерьевич Балакин, д. х. н., руководитель направления разработки инновационных лекарственных средств ООО «НИИ ХимРар», в. н. с. Московского физико-технического института (Национальный исследовательский университет)
Автор: Константин Валерьевич Балакин, д. х. н., руководитель направления разработки инновационных лекарственных средств ООО «НИИ ХимРар», в. н. с. Московского физико-технического института (Национальный исследовательский университет)
Ранее мы показали, что разработка модифицированных лекарственных аналогов типа «следующие в классе» является актуальным вектором развития инновационной фарминдустрии КНР. В упрощенном изложении суть подхода состоит в том, что появляющиеся в мире высокоинновационные молекулы типа «первые в классе» немедленно берутся в систематическую разработку в качестве прототипов для конструирования и быстрого внедрения структурно модифицированных патентоспособных аналогов. Сегодня эта стратегия является действенным инструментом достижения технологического суверенитета КНР в сфере лекарственного обеспечения.
В противоположность этому фокус на инновационных лекарственных препаратах категории «первый в классе» является особенностью регистрационной политики ведущего в мире национального регулятора – FDA США. Так, в 2022 году доля таких препаратов составила 54% (20 из 37 зарегистрированных продуктов). Было бы интересно, однако, проследить, насколько официальная статистика соответствует реальному положению дел. В настоящей статье представлен экспресс-анализ самых свежих лекарственных препаратов, одобренных FDA США в 2023 году, опирающийся не на оценки FDA, а на объективные научные данные. Попытаемся понять, насколько широко в актуальной практике FDA представлены новые молекулы, дизайн которых основан – прямо или косвенно – на ранее известных структурах.
Препараты, одобренные FDA в 2023 году: ищем аналоги
В табл. 1 представлены низкомолекулярные лекарственные препараты, зарегистрированные в США в период с 1 января по 31 октября 2023 года.
Табл. 1. Низкомолекулярные лекарственные средства, зарегистрированные FDA США с января по октябрь 2023 г.
| Препарат (компания-разработчик) | Дата регистрации | Биомишень, механизм действия | Индикация | Аналоги (компания-разработчик, год) |
| Vamorolone (Santhera Pharmaceuticals) | 26.10.2023 | Агонист глюкокортикоидных и антагонист минералокортикоидных рецепторов | Мышечная дистрофия Дюшенна | Структурные аналоги – Hydrocortisone (1941), Prednisolone (1955) |
| Etrasimod (Arena Pharmaceuticals, Pfizer) | 12.10.2023 | Cелективный модулятор рецепторов сфингозин-1-фосфата | Язвенный колит | Аналог с реструктурированным центральным молекулярным фрагментом – Siponimod (Novartis, 2019), а также ряд непрямых аналогов, действующих на ту же мишень |
| Gepirone (Fabre-Kramer Pharmaceuticals) | 22.09.2023 | Частичный агонист серотониновых 5-HT1A-рецепторов | Тяжелое депрессивное расстройство | Аналоги – Buspirone (Bristol-Myers Squibb, 1986) и ряд других пиронов |
| Momelotinib (GlaxoSmithKline) | 15.09.2023 | Ингибитор Янус-киназ JAK1 и JAK2 | Миелофиброз | Макроциклический аналог – Pacritinib (CTI BioPharma, 2022), а также ряд фармакофорных аналогов, действующих на ту же мишень |
| Zuranolone (Sage Therapeutics, Biogen) | 04.08.2023 | Положительный аллостерический модулятор ГАМК-рецепторов | Послеродовая депрессия | Аналог – Brexanolone, природный гормон аллопрегнанолон (Sage Therapeutics, 2019) |
| Lotilaner (Tarsus Pharmaceuticals) | 25.07.2023 | Ингибитор ГАМК-зависимых хлоридных каналов | Терапия блефарита, вызванного клещом Demodex | Аналоги – Fluralaner, Afoxolaner и другие ветеринарные антипаразитарные препараты изоксазолинового типа (на рынке с 2014 г.) |
| Ritlecitinib (Pfizer) | 23.06.2023 | Ингибитор Янус-киназы JAK3 | Очаговая алопеция | Аналоги – Tofacitinib (Pfizer, 2012) и широкий ряд других ингибиторов JAK |
| Perfluorhexyloctane (Bausch & Lomb, Novaliq) | 18.05.2023 | Предположительно, препарат уменьшает испарение влаги за счет формирования монослоя на поверхности слезной пленки | Терапия синдрома сухости глаз | Перфторгексилоктан уже не одно десятилетие входит в состав одобренных офтальмологических композиций (напр., Densiron 68) |
| Fezolinetant (Astellas Pharma US) | 12.05.2023 | Селективный антагонист рецепторов нейрокинина-3 (NK3) | Приливы жара (вазомоторные симптомы), обусловленные менопаузой | Непрямые аналоги – Osanetant, Pavinetant, Talnetant и другие антагонисты NK3, разрабатывавшиеся в 1990-2010 гг. |
| Leniolisib (Novartis, Pharming Group) | 24.03.2023 | Селективный ингибитор фосфоинозитол-3-киназы (PI3Kδ) | Синдром активированной PI3Kδ | Нет прямых структурных аналогов, но имеется ряд препаратов, действующих по тому же механизму |
| Rezafungin (Cidara Therapeutics) | 22.03.2023 | Ингибитор 1,3-бета-глюкан синтазы | Кандидемия и инвазивный кандидоз | Аналоги – Anidulafungin (Pfizer, 2006) и другие эхинокандины |
| Trofinetide (Acadia Pharmaceuticals) | 10.03.2023 | Механизм действия неизвестен | Синдром Ретта | Прямой аналог – трипептидный фрагмент природного нейропептида IGF-1 |
| Zavegepant (Pfizer) | 09.03.2023 | Антагонист пептидного рецептора CGRP | Мигрень | Непрямые аналоги –Ubrogepant (2019), Rimegepant (2020), Atogepant (2021) и другие гепанты, антагонисты CGRP |
| Omaveloxolone (Reata Pharmaceuticals) | 28.02.2023 | Активатор фактора Nrf2 и ингибитор фактора NF-κB | Атаксия Фридрейха | Аналог – Bardoxolone methyl (Reata Pharmaceuticals), клинический лекарственный кандидат |
| Sparsentan (Travere Therapeutics) | 17.02.2023 | Антагонист рецептора эндотелина типа А и рецептора ангиотензина II типа 1 | Протеинурия у взрослых с первичной нефропатией | Аналог – Irbesartan (Sanofi-Aventis, 1997) |
| Elacestrant (Stemline Therapeutics) | 27.01.2023 | Селективный модулятор рецепторов эстрогена | Эстроген-зависимый рак молочной железы с ESR1-мутантным EGFR | Фармакофорные аналоги, действующие по аналогичному механизму: Tamoxifen (1978), Raloxifene (1997), Bazedoxifene (2013) и др. |
| Pirtobrutinib (Eli Lilly) | 27.01.2023 | Ингибитор тирозиновой киназы Брутона | Рецидивирующая или рефрактерная мантийноклеточная лимфома | Нет прямых структурных аналогов, но имеется ряд препаратов, действующих по тому же механизму |
| Bexagliflozin (TheracosBio) | 20.01.2023 | Ингибитор натрий-глюкозного сотранспортера 2 (SGLT-2) | Сахарный диабет 2 типа | Аналоги – Dapagliflozin (Bristol-Myers Squibb, 2012) и широкий ряд других глифлозинов |
Отдельно в табл. 2 представлены соединения, которые на момент регистрации в США уже были одобрены в другой стране.
Табл. 2. Низкомолекулярные лекарственные средства, зарегистрированные FDA США с января по октябрь 2023 г., но ранее уже одобренные в другой стране.
| Препарат (компания-разработчик, дата регистрации) | Предшествующие регистрации | Биомишень, механизм действия | Индикация | Примеры аналогов (компания-разработчик, год) |
| Palovarotene (Clementia Pharmaceuticals, 16.08.2023) | Канада, 2022 г. | Агонист рецептора ретиноевой кислоты гамма (RARγ) | Гетеротопическая оссификация | Tamibarotene (Nippon Shinyaku, 2007) и ряд агонистов RARγ в исследованиях (напр., BMS270394, TTNPB) |
| Quizartinib (Daiichi Sankyo, 20.07.2023) | Япония, 2019 г. | Ингибитор тирозиновой киназы FLT3 | Острая миелоидная лейкемия | Sorafenib (Bayer, 2007) – непрямой аналог |
| Sotagliflozin (Lexicon Pharmaceuticals, 26.05.2023) | ЕС, 2019 г. | Ингибитор натрий-глюкозных сотранспортеров 1 и 2 (SGLT-1, SGLT-2) | Риск смерти из-за сердечно-сосудистой недостаточности | Dapagliflozin (Bristol-Myers Squibb, 2012) |
| Daprodustat (GlaxoSmithKline, 01.02.2023) | Япония, 2019 г. | Ингибитор пролил-гидроксилазы HIF | Анемия, вызванная хронической болезнью почек | Roxadustat (FibroGen, 2018), Enarodustat (Japan Tobacco, 2020) |
Анализ независимых научных источников показывает, что большинство – около 70% – из указанных в таблицах 1 и 2 соединений являются прямыми или достаточно близкими структурными аналогами известных лекарственных препаратов или соединений, дошедших ранее до продвинутых фаз клинических исследований. Эти данные хорошо коррелируют с недавним исследованием, показавшим, что 59% клинических лекарственных кандидатов, описанных в 2018-2021 годах в Journal of Medicinal Chemistry ACS, основаны на аналоге1. Важно, что даже при высоком уровне структурного сходства новые аналоги являются не просто структурными или функциональными копиями предшественников, но обладают улучшенными фармакологическими свойствами.
Реже в таблицах 1 и 2 встречаются непрямые (фармакофорные) аналоги или соединения, не имеющие очевидных структурных соответствий среди зарегистрированных препаратов. Однако и эти разработки также в значительной степени основаны на известных соединениях, принадлежащих тому же структурно-функциональному типу.
Следует отметить, что статус «первый в классе» присваивается FDA США лишь по итогам года в ходе отдельного рассмотрения. Поэтому мы пока не знаем, какие из представленных соединений станут его обладателями, но тем интереснее будет вернуться к этому вопросу в начале будущего года.
«Первые» или «следующие»? Особенности регуляторной политики FDA
В последние годы в практике FDA наблюдается тенденция к искусственному освежению реального инновационного статуса лекарств. Приведем три примера из одобрений 2021 года (рис. 1).
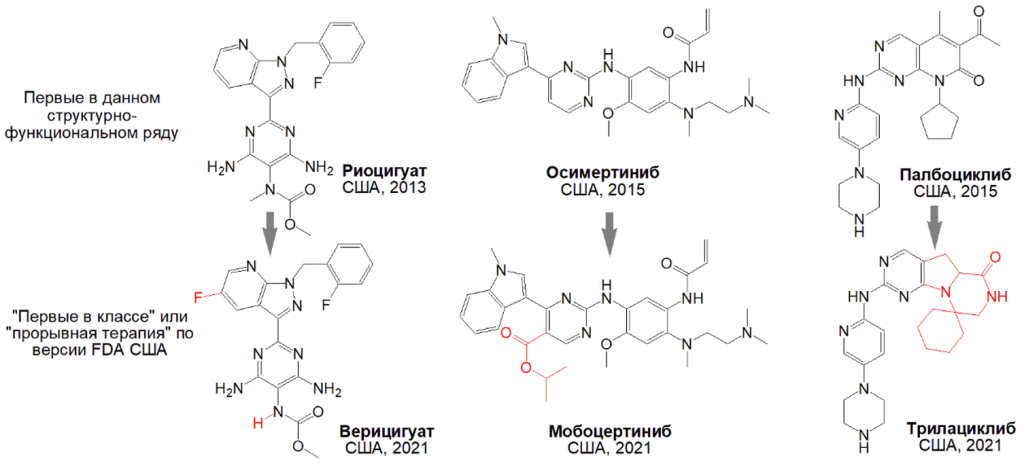
Красным выделены структурные отличия от предшественника. В каждом случае более поздний аналог получил в FDA статус «первого в классе» или «прорывной терапии».
Риоцигуат и верицигуат стимулируют растворимую гуанилатциклазу, регулирующую клеточные процессы в миокарде и сосудах2. Несмотря на полную структурную аналогию, появившийся спустя восемь лет верицигуат получил в FDA статус «первого в классе» из-за новой индикации – средство снижения риска сердечно-сосудистой смерти при сердечной недостаточности (показание риоцигуата – легочная гипертензия).
Вторая пара – ингибиторы рецептора EGFR для терапии мутантных форм немелкоклеточного рака легкого (НМРЛ). Минимальное структурное различие мобосертиниба от осимертиниба позволяет ему селективно действовать на специфическую мутацию EGFR в экзоне 20 при НМРЛ3. В США мобосертиниб отнесли к «прорывной терапии».
Третья пара – ингибиторы киназ CDK 4/6, средства терапии тяжких форм рака4. Палбоциклиб является «первым в классе», но этого же звания, а также статуса «прорывная терапия» удостоился спустя шесть лет и его аналог трилациклиб благодаря регистрации по новой терапевтической индикации.
Отметим, что глоссарий медицинско-химических терминов ИЮПАК «первым в классе» называет первый вышедший на рынок лекарственный препарат, воздействующий на молекулярную мишень, прежде не использованную для этих целей5. В соответствии с этим определением ни один из более поздних аналогов, представленных на рис. 1, не может считаться первым в классе. Однако в практике FDA США термин «первый в классе» имеет несколько иную трактовку: «фармацевтический препарат, использующий новый и уникальный механизм действия для лечения определенного заболевания»6. То есть американский регулятор уходит от обозначения мишени, но вводит указание на конкретное заболевание. Именно эти кажущиеся незначительными изменения на практике влекут за собой серьезные последствия, что мы и видим в рассмотренных выше примерах. Можно сделать вывод, что статус «первого в классе» или «прорывного» препарата, по версии FDA США, не гарантирует реальной высокой структурной и функциональной новизны, а может отражать лишь отдельные аспекты клинико-фармакологического статуса.
Выводы
Несмотря на попытки искусственного завышения регулятором США инновационного статуса отдельных препаратов, не вызывает сомнений высокая общая инновационность регистрационного портфеля FDA, в котором регулярно появляются действительно прорывные продукты. Однако объективный анализ свидетельствует о том, что доминирующим типом одобряемых в США новых лекарств являются аналоги типа «следующие в классе». Именно это является и общемировой тенденцией.
Опыт как КНР, так и США отражает, хотя и с несколько различного ракурса, тот факт, что разработка лекарственных аналогов является наиболее продуктивной исследовательской стратегией. По нашему мнению, в современной геополитической ситуации лишь эта стратегия способна в ускоренные сроки обеспечить технологический суверенитет нашей страны в лекарственной сфере.
- Brown D.G. // J Med Chem. 2023. Vol. 66. N 11. P. 7101-7139. doi 10.1021/acs.jmedchem.3c00521.
- Kansakar S., Guragain A., Verma D. et al. // Cureus. 2021. Vol 13. N 9. e17781. doi: 10.7759/cureus.17781.
- Markham A. // Drugs. 2021. Vol. 81. N 17. P. 2069-2074. doi: 10.1007/s40265-021-01632-9.
- Shah M., Nunes M.R., Stearns V. // Oncology (Williston Park). 2018. Vol. 32. N 5. P. 216-222.
- Buckle D.R., Erhardt P.W., Ganellin C.R. et al. // Pure Appl. Chem. 2013. Vol. 85. N 8. P. 1725–1758. http://dx.doi.org/10.1351/PAC-REC-12-11-23.
- Lanthier M., Miller K.L., Nardinelli C., Woodcock J. // Health Affairs. 2013. Vol. 32. N 8. P. 1433–1439. doi:10.1377/hlthaff.2012.0541.





